Cerdanyola del Vallès, 27 de noviembre de 2017. Aunque el monóxido de carbono puede llegar a ser mortal, se ha demostrado que su liberación en pequeñas dosis controladas puede ser beneficiosa debido, por ejemplo, a sus propiedades antiinflamatorias, vasodilatadoras y cardioprotectoras. Ahora, se ha comprobado la utilidad de unos nuevos sistemas desarrollados por investigadores de la Universitat Autònoma de Barcelona (UAB), con la colaboración del Institut de Recerca de l'Hospital de la Santa Creu i Sant Pau y el Sincrotrón ALBA, que transportan moléculas que liberan monóxido de carbono (conocidas como CORMs, del inglés carbon monoxide releasing molecules) al ser irradiados con luz visible o con luz ultravioleta.
Los metalosomas son agregados vesiculares formados por fosfolípidos y metalotensiactivos (moléculas que tienen una zona con afinidad al agua, otra que la repele y un metal) con un tamaño inferior a 1 micra. Las vesículas referidas, así como otras estructuras que se obtienen utilizando diferentes proporciones de las dos moléculas constituyentes (como las micelas o las bicelas) son estables a la dilución, lo que permite su utilización para dirigirse a las áreas donde se puede aplicar el efecto del monóxido de carbono. En comparación con otros compuestos metálicos, se ha demostrado que la toxicidad de los metalosomas es entre 10 y 20 veces inferior y, por lo tanto, son adecuados para aplicaciones médicas.
En la línea de luz MIRAS del Sincrotrón ALBA se ha analizado cómo estos sistemas interactúan con las células. Utilizando la técnica de microespectroscopia de infrarrojo los investigadores fueron capaces de identificar los compuestos dentro de las células, demostrando así su capacidad como sistema de liberación.
Esta investigación, resultado de la tesis doctoral de Maribel Marín-García que ha sido recientemente defendida, abre una nueva vía a la utilización de sistemas mixtos de fosfolípidos y metalotensioactivos con aplicaciones médicas y, más específicamente, a la utilización del monóxido de carbono como terapia de una manera controlada y dirigida.
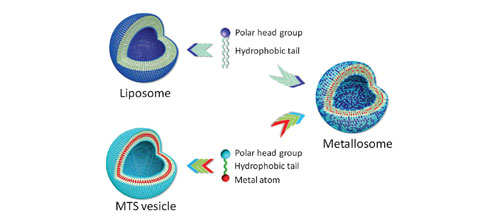
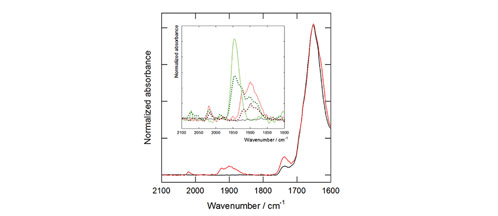
Fig 1: Esquema de cómo se forman los metalosomas. Fig 2: Espectro de infrarrojo de las células en la presencia (negro) y ausencia (rojo) de CO (TCO/SPC 1000:3000 mM/mM durante 12 h). Detalle de la región de absorción del CO del cultivo celular incubado con los diferentes agregados: TCO/SPC 1000:3000 mM/mM; TCO/SPC 1000:500 mM/mM, PCO/SPC 1000:3000 mM/mM y PCO/SPC 1000:300 mM/mM.


El grupo de investigadores en la línea de luz MIRAS del Sincrotrón ALBA. De izquierda a derecha, en la foto de grupo, Joan Suades, Maribel Marín-García, Núria Benseny, Ramon Barnadas y Mercedes Camacho.




