|
|
Cerdanyola del Vallès, 4 de octubre 2017. Plasmodium falciparum es el culpable de la malaria. Este parásito, transmitido con las picaduras de mosquito, llega a la sangre e infecta los glóbulos rojos de su víctima. Una vez dentro, usa como nutriente la hemoglobina (la proteína encargada del transporte de oxígeno en la sangre). Al digerirla, se producen residuos de hierro en forma de moléculas llamadas hemo. Estos grupos hemo son tóxicos para el parásito pero él tiene una estrategia para que no le perjudiquen: los junta de dos en dos y después los agrupa formando cristales de hemozoína, de manera que el hierro tóxico queda bloqueado y ya no representa una amenaza para él. |
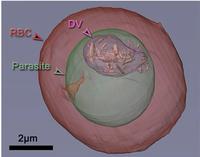
| Tomografía donde se ve el parásito (marcado en verde) dentro del glóbulo rojo (RBC marcado en rojo). En el parásito se observa la vacuola digestiva (DV) donde se concentran los cristales de hemozoína formados. | |
Aún no se sabe exactamente cómo el parásito cristaliza los hemo, pero ahora el grupo de investigación, liderado por Sergey Kapishnikov de la Universidad de Copenhagen, ha podido calcular por primera vez la velocidad de este proceso de cristalización con imágenes del parásito congelado in vivo. La clave del mecanismo bioquímico del parásito es que se deben coordinar las dos reacciones del proceso: la digestión de hemoglobina y la cristalización de los hemo. Como si de una cadena de montaje se tratara, la degradación inicial no puede ser más rápida que la cristalización; si no, los tóxicos grupos hemo resultantes se acumularían y la maquinaria siguiente encargada de tratarlos no daría al abasto de convertirlos en cristales. En consecuencia, los investigadores proponen un nuevo modelo del proceso donde predicen que necesariamente tiene que haber un mecanismo que controle y regule la velocidad de degradación de hemoglobina y, por tanto, también limite la liberación de grupos hemo.
Este descubrimiento es muy útil para el diseño de nuevos fármacos, cuyo objetivo sería sabotear este proceso de gestión de residuos: ya sea impidiendo la reacción que empaqueta los hemo tóxicos; o haciendo que se acumulen muchos de ellos atacando el sistema de coordinación entre ambos pasos – degradación y cristalización –, de manera que el parásito acabe ahogándose en sus propios escombros acumulados.
|
|
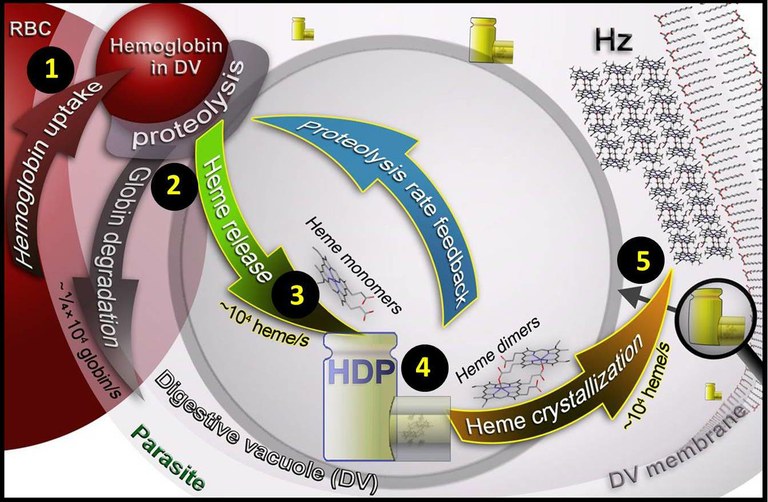
Modelo propuesto del proceso bioquímico que sucede dentro del parásito. El parásito coge hemoglobina del glóbulo rojo (RBC) 1 y la digiere dentro la vacuola digestiva (DV) 2. Como consecuencia se liberan grupos hemo 3 que una proteína (HDP) se encarga de agrupar de dos en dos (heme dimers) 4 y finalmente tiene lugar la cristalización y se forman los cristales de hemozoína 5. La flecha azul indica el sugerido sistema de feedback para controlar la degradación de hemoglobina. |
La investigación se ha realizado gracias a la cooperación entre diversos centros internacionales: el Niels Bohr Institute de la Universidad de Copenhagen, el Helmholtz Research Center de Berlín, el Paul Scherrer Institute de Suiza, el Weizmann Institute of Science de Israel, el Sincrotrón ALBA, el sincrotrón suizo SLS y el europeo ESRF en Francia.
Combinando dos avanzadas técnicas de luz de sincrotrón
En el laboratorio, los científicos han infectado glóbulos rojos humanos con el parásito y han obtenido imágenes in situ desarrollando una nueva metodología. La novedad es que han combinado dos avanzadas técnicas: la microscopia de transmisión de rayos X blandos y la microscopia de fluorescencia de rayos X. La primera, la microscopia de rayos X de la línea de luz MISTRAL del Sincrotrón ALBA, permite obtener tomografías: imágenes de alta resolución en 3D de células. Con esta técnica también se estudió el primer glóbulo rojo infectado en BESSY-II, sincrotrón en Berlín. Por otro lado, la microscopia de fluorescencia de rayos X – llevada a cabo en el sincrotrón suizo y más recientemente en el sincrotrón ESRF en Francia – permite ver donde se encuentran elementos como el hierro, el potasio o el azufre dentro la célula.
La proporción entre azufre y hierro por ejemplo, permite deducir si el hierro que se observa con la fluorescencia es de los cristales de hemozoína, de la hemoglobina o son grupos hemo libres, i así acabar calculando las concentraciones de las diferentes moléculas. Además, analizando la cantidad de hierro presente en el parásito en función del tiempo, se ha deducido la ya comentada tasa de cristalización. Al haber hasta ahora varios modelos propuestos de cristalización, cada uno con su teórica tasa, el cálculo hecho in vivo ha permitido identificar cuál de ellos sería el más acertado.
|
|
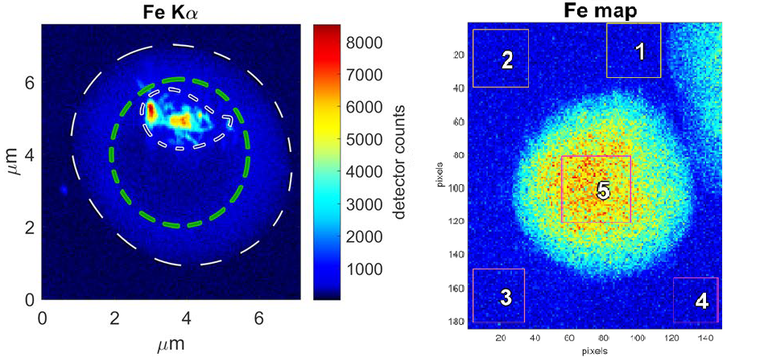
Mapas de fluorescencia de hierro. A la izquierda, célula infectada con el hierro concentrado dentro la vacuola digestiva del parásito. Corresponde al hierro presente en los cristales de hemozoína. La distribución de hierro es claramente diferente a la de la célula no infectada de la derecha, donde está repartido por todo el citosol en forma de hemoglobina que no ha sido destruida. Cada pixel corresponde a 50nm. |
Finalmente, el análisis de las imágenes de microscopia ha permitido también medir por primera vez cierta cantidad de grupos hemo no cristalizados dentro del parásito. Esto, es ciertamente sorprendente porqué ya se sabe que estos compuestos son tóxicos de forma inmediata y, según la tasa de cristalización calculada, harían falta 1'4 horas para procesarlos. Esto significa que el parásito tiene alguna forma de guardar estos hemo para qué no le maten: "probablemente asociados a hemoglobina aún no digerida", según sugieren los científicos.
Una nueva diana para atacar el parásito
Todos estos resultados han llevado a los investigadores a proponer un nuevo modelo de cristalización con sistema de feedback, ya que todo indica que las reacciones deben estar controladas: la degradación de la hemoglobina no puede ser más rápida que la cristalización de hemo. No saber exactamente los mecanismos del parásito ha estado retrasando el desarrollo de tratamientos contra la malaria, enfermedad que afecta centenares de millones de personas en el mundo, muchos de los cuales niños. Actualmente las resistencias que aparecen después de un uso continuado de un cierto fármaco antimalárico claman la necesidad de nuevos medicamentos eficaces. El siguiente paso es pues, ver cómo exactamente se coordinan la degradación de hemoglobina y la cristalización para poder encontrar un punto donde atacar. Si este sistema de información se interrumpiera, el parásito moriría.