Sincrotró ALBA
Usant la línia de llum XALOC del Sincrotró ALBA, un equip del Centro de Investigación del Cáncer de la Universidad de Salamanca ha obtingut una imatge 3D detallada de la unió entre dues proteïnes dels hemidesmosomes. Els resultats, publicats a la revista Structure, ajuden a entendre com es formen aquestes estructures d’adhesió dels epitelis.
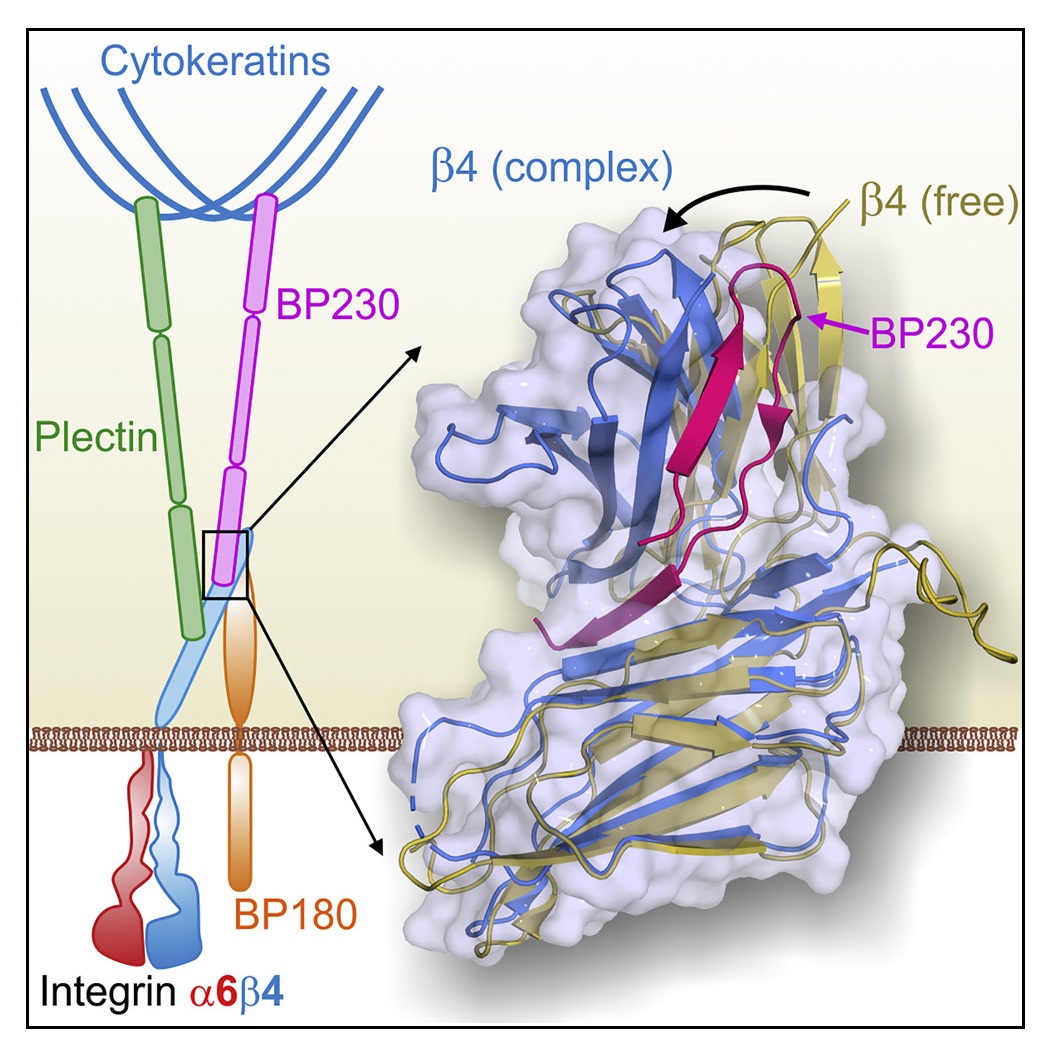
Un equip del Centro de Investigación del Cáncer - Instituto de Biología Molecular y Celular del Cáncer de Salamanca, del Centro Universitario de la Defensa de Zaragoza, i del Netherlands Cancer Institute d'Amsterdam ha descrit com interaccionen dues proteïnes essencials per mantenir la unió entre epidermis i dermis. L’estudi revela a nivell atòmic com es produeix la unió entre dues proteïnes dels hemidesmosomes: la integrina α6β4 i la BP230.
Els epitelis, com l’epidermis, reposen sobre unes làmines fibroses, anomenades membranes basals, formades per proteïnes de matriu extracel·lular. La unió entre epitelis i membranes basals es produeix a través d’uns complexos multi-proteïna localitzats a la membrana de les cèl·lules epitelials, anomenats hemidesmosomes. La integrina α6β4 és una proteïna essencial dels hemidesmosomes que s’adhereix a proteïnes de la membrana basal. Al citoplasma de la cèl·lula, les proteïnes plectina i BP230 s’uneixen a α6β4 i la connecten amb els filaments intermedis del citoesquelet. Alteracions genètiques o autoimmunes que afecten a proteïnes dels hemidesmosomes redueixen la resistència de la pell i causen malalties com el pemfigoid ampul·lar i diversos tipus d’epidermòlisi bullosa.
"Malgrat la seva rellevància pel manteniment de la integritat de la pell i altres epitelis, encara se sap molt poc sobre l’estructura i l’organització dels hemidesmosomes. Tampoc està massa clar com es formen i es separen aquestes estructures.", explica José María de Pereda, investigador del CSIC al Instituto de Biología Molecular y Celular del Cáncer i investigador principal del grup.
Amb l’objectiu de comprendre com s’organitzen els hemidesmosomes, l’equip d’investigació ha analitzat la interacció entre les proteïnes α6β4 i BP230. Primer, han identificat les regions de α6β4 i BP230 entre les quals es produeix el contacte. Seguidament, han emprat la cristal·lografia de raigs X per resoldre l’estructura de β4 unida a BP230. "Amb anterioritat havíem caracteritzat la interacció entre α6β4 i la plectina. Ara hem vist que BP230 s’uneix a α6β4 d’una forma totalment diferent." explica el Dr. de Pereda. Aquest anàlisi s’ha realitzat en la línia de difracció de macromolècules XALOC, al Sincrotró ALBA, que permet resoldre l’estructura de les proteïnes a nivell atòmic. "El l’alt nivell de detall obtingut ha permès identificar aminoàcids en α6β4 i BP230 que juguen un paper clau perquè ambdues proteïnes encaixin entre elles" afegeix. Per aquest estudi, també s’han obtingut dades en d’altres sincrotrons com Diamond (Regne Unit) i EMBL-DESY (Alemanya).
La recerca també ha revelat que la unió de BP230 a α6β4 és necessària per la incorporació de BP230 als hemidesmosomes. Per altra banda, els resultats suggereixen mecanismes que podrien trencar aquesta unió quan els hemidesmosomes es dissocien, per exemple durant la cicatrització de ferides.