Sincrotró ALBA
Un equip d'investigadors del CIC bioGUNE, de la Universitat de Liverpool i l'hospital Cedars-Sinai a Califòrnia aconsegueixen determinar amb precisió atòmica el funcionament de l'enzim MATα2. Aquest estudi, amb dades recollides a ALBA, obre noves vies per al desenvolupament de molècules que puguin regular el mecanisme d'aquest enzim involucrat en el creixement de cèl·lules canceroses.
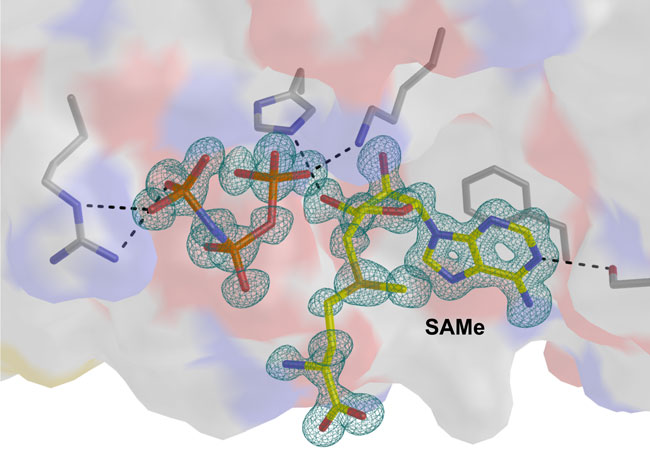
Aquest enzim sintetitza una molècula anomenada SAMe que és fonamental per al bon funcionament de les cèl·lules. A les cèl·lules normals, la molècula SAMe és produïda per una proteïna homòloga MATα1, però a les cèl·lules canceroses la MATα1 no es produeix i pren la seva funció la MATα2, que altera la producció de SAMe contribuint a la reproducció de cèl·lules canceroses.
Els científics del CIC bioGUNE han obtingut per primera vegada un conjunt d'estructures cristal·lines on s'observen diverses etapes de la reacció enzimàtica de la MATα2, cosa que permet veure amb detall el mecanisme d'acció catalítica. Aquesta informació possibilita el desenvolupament futur de molècules que puguin regular la funció d'aquest enzim.
Una part de la investigació es va dur a terme al Sincrotró ALBA (a la línia de llum XALOC) i a Diamond (I04-1) a Anglaterra.
La investigadora del CIC bioGUNE Adriana Rojas, responsable d'aquest estudi publicat a Proceedings of the National Academy of Sciences USA (PNAS), destaca la seva importància per la resolució aconseguida. "El fet de ser capaços de veure la proteïna cristal·litzada amb un angstrom de resolució ens permet tenir informació molt precisa pel past següent, que seria dissenyar molècules que podrien utilitzar-se en una fàrmac destinat a bloquejar o reduir l'activitat d'aquesta molècula".
La investigació s'emmarca dins dels estudis portats a terme durant els últims trenta anys per en José María Mato, Director General de CIC bioGUNE, i el seu equip en l'àmbit del càncer de fetge.
