Sincrotró ALBA
Durant segles, la quinolina ha estat un compost eficaç pels medicaments antipalúdics, tot i que ningú coneixia el seu mode d’acció in vivo. Un equip liderat per l’Institut Weizmann ha descobert el seu mecanisme en glòbuls vermells infectats de malària sota condicions gairebé natives. Han usat tècniques de llum de sincrotró en tres sincrotrons diferents: l’ALBA, ESRF a França i BESSY a Alemanya. Els seus resultats es publiquen avui a la revista PNAS.
El Plasmodium falciparum, transmès amb les picades de mosquit, és el causant de la malària. Arriba a la sang iinfectaelsglòbulsvermells de la seva víctima. Durant les dues últimes dècades, el paràsit ha desenvolupat resistències als fàrmacs. "Recentment, la creixent dispersió geogràfica de l'espècie, així com l'aparició de soques resistents, preocupen a la comunitat científica, i per millorar els fàrmacs contra la malària hem de conèixer com funcionen amb precisió", explica el líder de l'estudi Sergey Kapishnikov, de la Universitat de Copenhaguen i l'Institut Weizmann, a Israel.
Un cop dins els glòbuls vermells, el Plasmodium agafa com a nutrient l'hemoglobina (la proteïna encarregada del transport de l'oxigen per la sang). Després de la digestió, s'alliberen molècules hemo que contenen ferro i són tòxiques per al paràsit. Tot i això, aquestes molècules cristal·litzen en hemozoïna, un producte de rebuig de la digestió de la sang pel paràsit que fa que les molècules romanguin inertes. Com van publicar en anteriors estudis, per tal que el Plasmodium sobrevisqui, la velocitat amb què s'alliberen les molècules hemo ha de ser més lenta o igual que la taxa de cristal·lització d'hemozoïna. En cas contrari, hi hauria una acumulació d'hemo tòxic dins del paràsit i moriria.
Els fàrmacs de la família de la quinolina, que inclouen píndoles contra la malària basades en quinina, danyen efectivament el paràsit. La comunitat científica sospita que el motiu del seu èxit és la incapacitat de cristal·lització dels grups hemo. Fins ara, tots els estudis sobre l'acció del fàrmac sobre els cristalls d'hemo s'havien fet en sistemes models o en mostres de paràsits secs, fet que proporcionava dades limitades i obria la porta a l'especulació. L'equip de Kapishnikov, que inclou científics de Dinamarca, Espanya, Alemanya, Israel i França, va decidir conèixer el mode d'acció de fàrmacs ja establerts, com la cloroquina (tot i que utilitzen el seu anàleg bromoquina) en glòbuls vermells infectats amb Plasmodium falciparum completament hidratats i congelats. La congelació ràpida és un mètode que crea instantànies de les diferents etapes de vida de les cèl·lules, de manera que la distribució química no es veu alterada pels tractaments de preparació de mostres.
Anàlisis complementàries entre sincrotrons
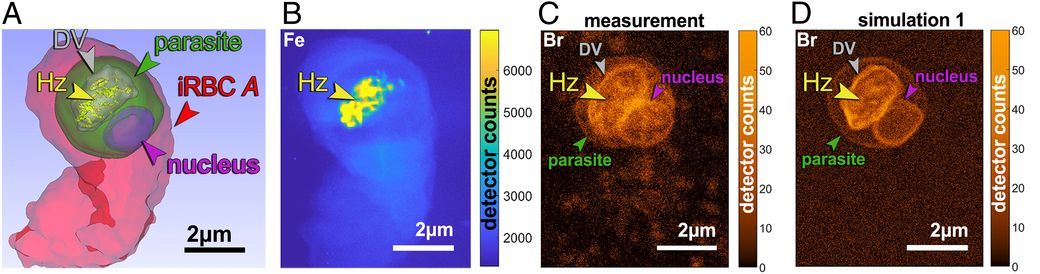
En aquest cas, les cèl·lules criogenitzades van viatjar per tota Europa. L'equip de recerca les van dur a analitzar en diferents fonts de llum de sincrotró. Primer a la línia MISTRAL del Sincrotró ALBA i BESSY-II de Berlín, per tal que la seva estructura es pugui cartografiar en tres dimensions mitjançant la crio-tomografia de raigs X. Aquesta tècnica, només disponible a quatre sincrotrons en el món (Diamond al Regne Unit, ALS als EUA i els dos esmentats), és l'única forma de visualitzar les cèl·lules senceres i en el seu estat natural sense ser tallades ni alterades per cap tractament químic.
Finalment, les cèl·lules es van portar a l'ESRF a Grenoble per fer un mapa de la distribució de brom i ferro mitjançant una tècnica de fluorescència de raigs X. Les dades obtingudes en tots els sincrotrons es van analitzar a Dinamarca on l'equip científic va determinar la correlació entre les diferents modalitats d'imatge i es van calcular i interpretar les concentracions de bromoquina a la superfície dels cristalls d’hemozoïna, a la membrana i dins del lumen del vacúol digestiu del paràsit, el punt d’acció dels fàrmacs.
Els resultats dels glòbuls vermells infectats analitzats han demostrat que la bromoquina capta els cristalls d’hemozoïna, inhibint així el seu creixement i, per tant, sabotejant la desintoxicació dels hemo. Sorprenentment, també han vist que la bromoquina s'acumula al sistema digestiu del paràsit, fet que millora l'eficiència del fàrmac en privar l'acoblament de les molècules hemo a la superfície del cristall d'hemozoïna.
"Aquests resultats mostren un model que es pot generalitzar a tots els fàrmacs de quinolina, com la quinina. El nostre enfocament també es pot estendre a d'altres famílies de medicaments antipalúdics, com ara les artemisinines", explica Kapishnikov. La malària continua sent una de les majors causes de mort als països més pobres. El nombre de morts estimades varia entre 450.000 i 720.000, la majoria a l'Àfrica. "Esperem que aquest nou descobriment permeti fer un pas més cap al disseny de nous medicaments més eficaços contra les soques resistents de la malària", conclou.
Amb la col·laboració de la Fundació Espanyola per a la Ciència i la Tecnologia. El Sincrotró ALBA forma part de la xarxa d'Unitats de Cultura Científica i de la Innovació (UCC+i) de la Fundació Espanyola per a la Ciència i la Tecnologia (FECYT) i ha rebut suport a través del projecte FCT-20-15798.