Sincrotró ALBA
Un grup de recerca de la línia de llum XALOC del Sincrotró ALBA ha descobert un domini proteic comú entre bacteris i humans en els factors de transcripció del material genètic. L’han batejat com a TetD.
Aquest descobriment mostra que els principis funcionals bàsics són molt similars entre els éssers vius i suggereix l'existència d'un avantpassat comú abans de l’aparició de la vida pluricel·lular. A més, la proteïna humana que té aquest domini TetD està relacionada amb l'aparició del càncer, per la qual cosa aquest estudi pot ajudar a entendre la regulació del desenvolupament de la malaltia.
La transcripció és un procés universal en tots els éssers vius en el qual la seqüència d'ADN d'un gen es copia (es transcriu) per fer una molècula d'ARN. És el primer pas per sintetitzar les proteïnes, indispensables per a les funcions de l'organisme.
Els factors de transcripció són proteïnes que controlen el procés de transcripció. Ho fan unint-se a una seqüència específica d'ADN. La seva funció és regular (activar i apagar) els gens per assegurar-se que s'expressen a les cèl·lules desitjades en el moment adequat i en la quantitat adequada durant tota la vida de la cèl·lula i de l'organisme.
Un equip d'investigació del Sincrotró ALBA liderat per Roeland Boer, cap de la línia de llum XALOC, ha estat estudiant una d'aquestes proteïnes. El seu nom és RcopLS20. És un regulador de la transcripció dels bacteris que exerceix la seva funció mitjançant la formació d'un bucle d'ADN. El crea en unir-se a dues regions de la cadena que estan separades per uns 75 parells de bases (les subunitats de les quals està format l'ADN). RcopLS20 conté un domini (una zona) de tetramerització que és el responsable d'induir aquest bucle d'ADN.
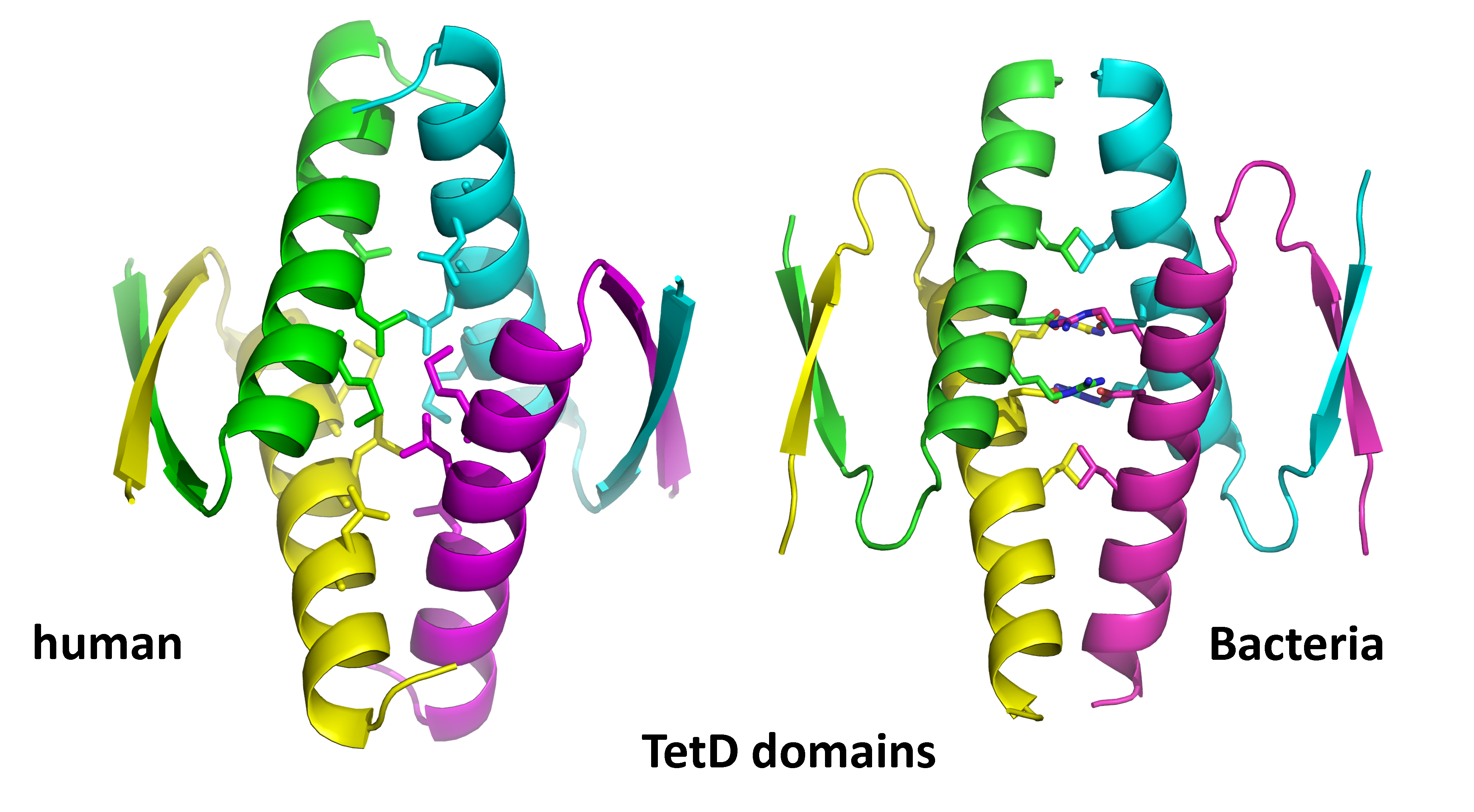
Els mecanismes de regulació de la transcripció són molt diferents entre procariotes (bacteris) i eucariotes (humans, per exemple). Fins ara, no s'havia vist cap homologia estructural entre les proteïnes tetramèriques que indueixen el bucle de l'ADN en eucariotes i procariotes respectivament. Ara, l'equip de l’ALBA ha fet servir llum de sincrotró per analitzar l'estructura del domini de tetramerització de RcopLS20 (RcoTetpLS20) i comparar-lo amb el domini de tetramerització de p53, una coneguda família de proteïnes humanes relacionada amb l'aparició del càncer.
Els resultats mostren que el domini de tetramerització de RcopLS20 té una gran similitud en la seva estructura quan la compares amb la de p53. Així, per primer cop s'ha descrit que la proteïna bacteriana RcopLS20 forma tetràmers i adopta una estructura similar a la que tenen la família de proteïnes humanes p53. El grup de recerca ha posat el nom de TetD a aquest domini proteic comú entre bacteris i humans.
Descobrir que aquest domini del factor de transcripció, el TetD, existeix en bacteris i humans amb una funció similar és una gran sorpresa. Suggereix que els principis bàsics de les funcions del sistema són molt semblants, malgrat les diferències òbvies que hi ha entre bacteris i humans." explica Nerea Bernardo, una de les científiques de l'equip. L’estudi publicat deixa entreveure que hi ha un mecanisme regulador comú en tots els regnes de la vida que controla la transcripció gènica, controlat pel TetDloop. La hipòtesi de l’equip investigador és que es va originar a partir d'un ancestre comú anterior a l'aparició de la vida pluricel·lular i ha persistit al llarg de milers de milions d'anys d'evolució.
A més a més, “la proteïna humana que presenta el domini TetD és un oncogen i està relacionada amb l'aparició de càncer. Esperem que el nostre estudi ajudi a entendre la regulació del desenvolupament d’aquesta malaltia." afegeix Isidro Crespo, investigador postdoctoral de XALOC.
Resoldre l’estructura de proteïnes amb llum de sincrotró
Per a aquest estudi, el grup de recerca va aplicar la cristal·lografia de macromolècules per poder determinar l'estructura del domini TetD bacterià. En primer lloc, van produir i purificar RcopLS20. Després, van haver d'obtenir cristalls de RcoTetpLS20. La cristal·lització de proteïnes no és una feina fàcil, ja que requereix grans quantitats de proteïna pura i provar més de 800 condicions diferents per tenir possibilitats de cristal·lització. Els cristalls van trigar tres mesos a créixer i després els van recol·lectar, refredant-los mitjançant la transferència directa de la gota de cristal·lització al nitrogen líquid. Els cristalls els van portar del laboratori a la línia de llum XALOC, on van col·locar-los a la cabina experimental per tal de ser irradiats amb la llum de sincrotró i analitzats amb la tècnica de difracció de raigs X. Finalment, després de la recollida i el processament de les dades, l'estructura obtinguda es va publicar al Protein Data Bank.
Per altra banda, també van fer assajos biofísics als laboratoris d’ALBA per estudiar el comportament in vitro de les proteïnes purificades i així confirmar els resultats estructurals obtinguts per cristal·lografia macromolecular. Finalment, van usar el programa d’intel·ligència artificial AlphaFOLD2 per generar un model computacional de la longitud completa de la proteïna que conté el domini TetD. Aquests models coincideixen amb les dades estructurals i bioquímiques i proporcionen una visió de la funció de la proteïna en el context del nucli de la cèl·lula.