Sincrotró ALBA
Investigadors de la UAB i l'IDIBELL han analitzat mostres cerebrals de la malaltia d'Alzheimer al Sincrotró ESRF i a l'ALBA per caracteritzar dos tipus de plaques amiloides amb diferències en la composició d'ions metàl·lics i en els seus nivells de lípids oxidats. Els resultats podrien conduir a nous coneixements sobre el desenvolupament de la patologia.
La malaltia d'Alzheimer va ser descrita per primera vegada per Alois Alzheimer el 1906 com una acumulació d'una substància no identificada en el cervell de persones afectades per demència. No va ser fins a 1987 que es va descriure el pèptid amiloide com el component principal d'aquests dipòsits, coneguts com plaques amiloides. El pèptid amiloide es processa en l'espai extracel·lular del cervell i tendeix a agregar-se, formant oligòmers que es desenvolupen encara més en fibril·les amiloides en un procés de polimerització depenent de nucleació. És conegut que la toxicitat de les fibril·les és baixa, els oligòmers i altres tipus d'agregats que es formen en condicions fisicoquímiques específiques (pH baix, ions metàl·lics, lípids oxidats) són tòxics per a les cèl·lules. El fet que aquests agregats amiloides tòxics hagin estat descrits fins ara principalment in vitro, fa que la seva identificació i caracterització en cervells afectats sigui un dels majors reptes en la investigació de amiloides.
Les tècniques de microscòpia basades en llum de sincrotró poden ajudar a dilucidar l'estructura i composició de les plaques amiloides. La microscòpia d'infraroig es basa en l'absorció de llum infraroja, que dóna informació sobre la composició química de les mostres. En mostres biològiques, és especialment interessant poder mesurar paràmetres com l'estructura secundària proteïna / pèptid i l'oxidació de lípids. La tècnica és particularment útil en el cas de l'agregació amiloide, ja que els pèptids / proteïnes agregats generen bandes espectroscòpiques molt específiques i fàcilment identificables en les regions de l'infraroig mitjà (entre 1620 i 1630 cm-1).
Un equip d'investigadors de la Universitat Autònoma de Barcelona i de l'Institut de Recerca Biomèdica de Bellvitge (IDIBELL), en col·laboració amb científics de l'ESRF, ha utilitzat microscòpia d'infraroig en la línia de llum ID21 i en la línia de llum MIRAS del Sincrotró ALBA per caracteritzar els agregats amiloides en mostres cerebrals de pacients en estadis avançats de la malaltia d'Alzheimer. Es van trobar dos tipus diferents d'agregats de pèptids amiloides: fibril (que s'han descrit prèviament) i, identificats per primera vegada en cervells afectats, agregats no fibril·lars amb un alt component d'estructura desordenada. A més, l'anàlisi espectroscòpic va permetre identificar els components lipídics oxidats associats a les plaques amiloides.
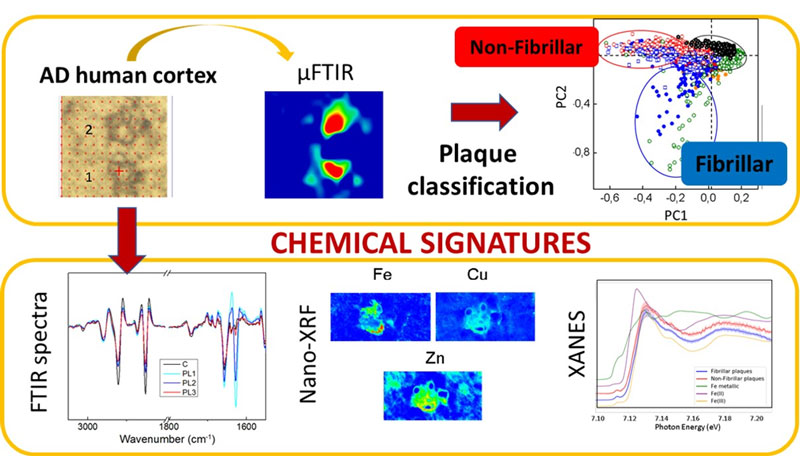
El paper dels cations metàl·lics també és un tema molt discutit en relació amb la malaltia d'Alzheimer, ja que els metalls, juntament amb els pèptids amiloides, poden estar involucrats en una reacció redox que podria conduir a estrès oxidatiu, el que podria estar relacionat amb el desenvolupament de la malaltia. La combinació de microscòpia d'infraroig amb fluorescència de raigs X (XRF) va permetre als investigadors estudiar la correlació entre diferents tipus de dipòsits d'amiloides i la seva composició d'ions metàl·lics (Figura 1). D'acord amb estudis previs, es va trobar que la concentració de metalls era major dins de les plaques amiloides que a l'àrea circumdant. Els mapes de distribució de nano-XRF mostren que el zinc i el coure es localitzen clarament amb els dipòsits d'amiloide, mentre que el ferro sembla estar associat amb la vora de la placa (Figura 2). Quant als diferents tipus de placa amiloide, es va trobar que la concentració de ferro era més gran en les plaques fibril·lars que en les no fibril·lars, mentre que els nivells de coure i zinc van ser similars en ambdós tipus de dipòsits amiloides. Els mesuraments d'espectroscòpia d'absorció de raigs X prop de l'estructura de la vora (XANES) mostren que les plaques amiloides no fibril·lars (amb una estructura desordenada augmentada) contenen Fe2+ i Fe3+, mentre que les plaques fibril·lars contenen principalment Fe3+.
En conclusió, s'ha descrit per primera vegada in situ en cervells humans amb malaltia d'Alzheimer avançada l'existència de dipòsits d'amiloide amb estructura desordenada / no fibril·lar, coexistint amb les típiques plaques fibril·lars. Tant les plaques desordenades com les fibril·lars acumulen ions metàl·lics, encara que el contingut de ferro està clarament augmentat en els dipòsits fibril·lars. Les plaques no fibril·lars contenen Fe2+ (no present en les plaques fibrilars) i estan associades amb nivells més alts d'oxidació de lípids. La presència de la forma Fe2+ activa redox en plaques no fibril·lars pot ser clau per a la seva participació en els processos redox que condueixen a un augment de l'estrès oxidatiu. La identificació, localització i caracterització d'espècies d'amiloide no fibril·lar potencialment tòxiques en els cervells afectats pot ser d'importància en la investigació de la malaltia d'Alzheimer, ja que aquestes formes poden precedir a la formació de fibril·les (no tòxiques) i estar més directament relacionades amb els efectes nocius.

Fig. 2: Exemple de distribució de metalls en plaques fibrilars i no fibril·lars.
ESRF spotlight