Sincrotrón ALBA
Investigadores de la UAB y el IDIBELL han analizado muestras cerebrales de la enfermedad de Alzheimer en el Sincrotrón ESRF y en ALBA para caracterizar dos tipos de placas amiloides con diferencias en la composición de iones metálicos y en sus niveles de lípidos oxidados. Los resultados podrían conducir a nuevos conocimientos sobre el desarrollo de la patología.
La enfermedad de Alzheimer fue descrita por primera vez por Alois Alzheimer en 1906 como una acumulación de una sustancia no identificada en el cerebro de personas afectadas por demencia. No fue hasta 1987 que se describió al péptido amiloide como el componente principal de estos depósitos, conocidos como placas amiloides. El péptido amiloide se procesa en el espacio extracelular del cerebro y tiende a agregarse, formando oligómeros que se desarrollan aún más en fibrillas amiloides en un proceso de polimerización dependiente de nucleación. Es conocido que la toxicidad de las fibrillas es baja, los oligómeros y otros tipos de agregados que se forman en condiciones fisicoquímicas específicas (pH bajo, iones metálicos, lípidos oxidados) son tóxicos para las células. El hecho de que estos agregados amiloides tóxicos hayan sido descritos hasta ahora principalmente in vitro, hace que su identificación y caracterización en cerebros afectados sea uno de los mayores desafíos en la investigación de amiloides.
Las técnicas de microscopía basadas en luz de sincrotrón pueden ayudar a dilucidar la estructura y composición de las placas amiloides. La microscopía de infrarrojo se basa en la absorción de luz infrarroja, que da información sobre la composición química de las muestras. En muestras biológicas, es especialmente interesante poder medir parámetros como la estructura secundaria proteína / péptido y la oxidación de lípidos. La técnica es particularmente útil en el caso de la agregación amiloide, ya que los péptidos / proteínas agregados generan bandas espectroscópicas muy específicas y fácilmente identificables en las regiones del infrarrojo medio (entre 1620 y 1630 cm-1).
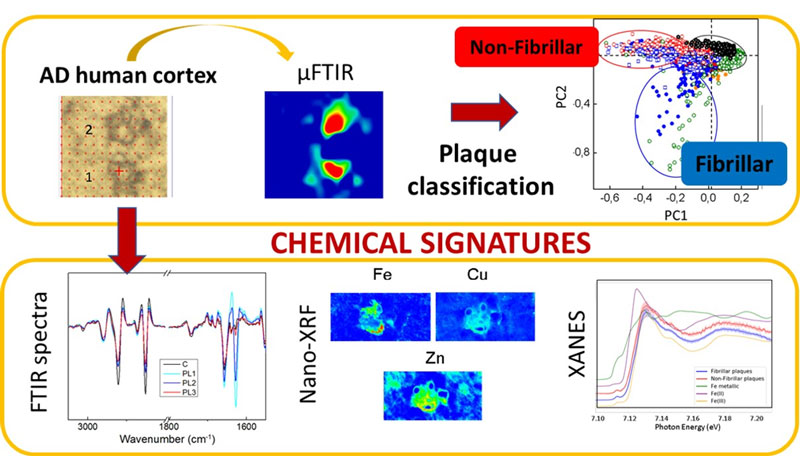
Un equipo de investigadores de la Universitat Autònoma de Barcelona y del Instituto de Investigaciones Biomédicas de Bellvitge (IDIBELL), en colaboración con científicos del ESRF, ha utilizado microscopía de infrarrojo en la línea de luz ID21 y en la línea de luz MIRAS del Sincrotrón ALBA para caracterizar los agregados amiloides en muestras cerebrales de pacientes en estadios avanzados de la enfermedad de Alzheimer. Se encontraron dos tipos diferentes de agregados de péptidos amiloides: fibrillas (que se han descrito previamente) e, identificados por primera vez en cerebros afectados, agregados no fibrilares con un alto componente de estructura desordenada. Además, el análisis espectroscópico permitió identificar los componentes lipídicos oxidados asociados a las placas amiloides.
El papel de los cationes metálicos también es un tema muy discutido en relación con la enfermedad de Alzheimer, ya que los metales, junto con los péptidos amiloides, pueden estar involucrados en una reacción redox que podría conducir a estrés oxidativo, lo que podría estar relacionado con el desarrollo de la enfermedad. La combinación de microscopía de infrarrojo con fluorescencia de rayos X (XRF) permitió a los investigadores estudiar la correlación entre diferentes tipos de depósitos de amiloides y su composición de iones metálicos (Figura 1). De acuerdo con estudios previos, se encontró que la concentración de metales era mayor dentro de las placas amiloides que en el área circundante. Los mapas de distribución de nano-XRF muestran que el zinc y el cobre se localizan claramente con los depósitos de amiloide, mientras que el hierro parece estar asociado con el borde de la placa (Figura 2). En cuanto a los diferentes tipos de placa amiloide, se encontró que la concentración de hierro era mayor en las placas fibrilares que en las no fibrilares, mientras que los niveles de cobre y zinc fueron similares en ambos tipos de depósitos amiloides. Las mediciones de espectroscopía de absorción de rayos X cerca de la estructura del borde (XANES) muestran que las placas amiloides no fibrilares (con una estructura desordenada aumentada) contienen Fe2+ y Fe3+, mientras que las placas fibrilares contienen principalmente Fe3+.
En conclusión, se ha descrito por primera vez in situ en cerebros humanos con enfermedad de Alzheimer avanzada la existencia de depósitos de amiloide con estructura desordenada / no fibrilar, coexistiendo con las típicas placas fibrilares. Tanto las placas desordenadas como las fibrilares acumulan iones metálicos, aunque el contenido de hierro está claramente aumentado en los depósitos fibrilares. Las placas no fibrilares contienen Fe2 + (no presente en las placas fibrilares) y están asociadas con niveles más altos de oxidación de lípidos. La presencia de la forma Fe2+ activa redox en placas no fibrilares puede ser clave para su participación en los procesos redox que conducen a un aumento del estrés oxidativo. La identificación, localización y caracterización de especies de amiloide no fibrilar potencialmente tóxicas en los cerebros afectados puede ser de importancia en la investigación de la enfermedad de Alzheimer, ya que estas formas pueden preceder a la formación de fibrillas (no tóxicas) y estar más directamente relacionadas con los efectos nocivos. del péptido amiloide en el desarrollo de la patología. Futuros experimentos para estudiar la presencia de estas formas no fibrilares en etapas tempranas de la enfermedad y su contenido de cationes metálicos serían de gran interés para el campo de investigación.

Fig. 2: Ejemplo de distribución de metales en placas fibrilares y no fibrilares.
ESRF spotlight