Sincrotró ALBA
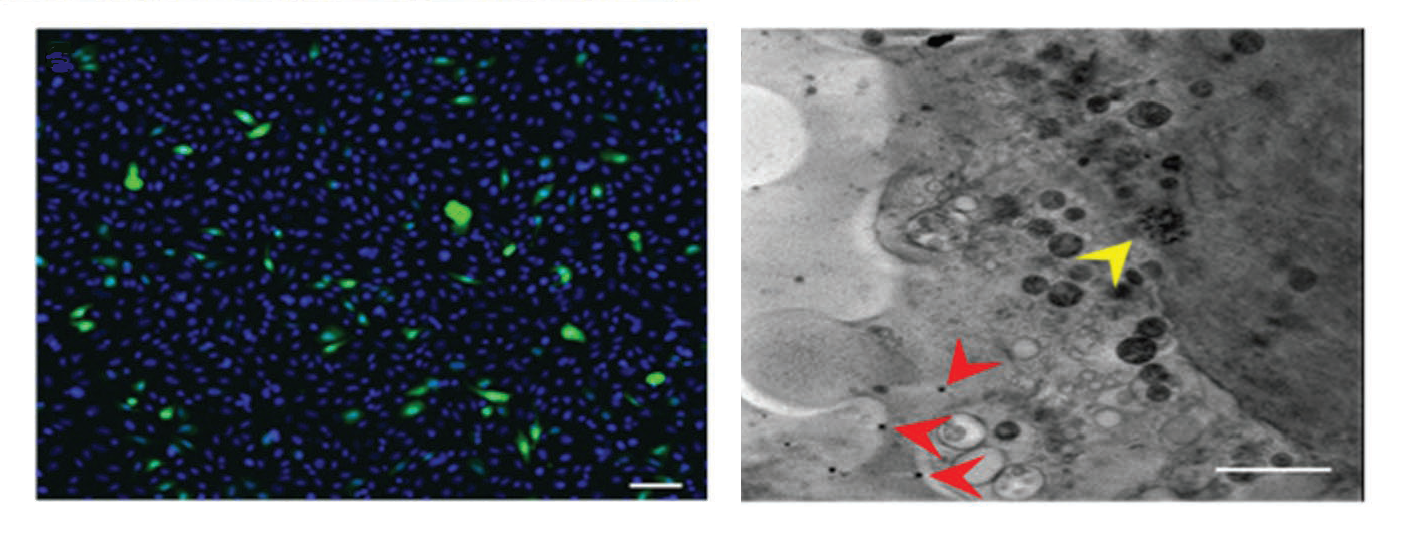
Un equip de recerca format per la Universitat RMIT, CSIRO Manufacturing, la Universitat de Nova Gal·les del Sud, la Universitat de Tecnologia de Graz i la Universitat d’Adelaide, a Austràlia, han demostrat que les MOFs poden ser un mètode fàcil i eficient per transportar paquets de gens intactes i de gran mida per aplicar-se en teràpia gènica. L’estudi consta de l’encapsulació d’un paquet de gens en MOFs del tipus framework-8 d’imidazolat zeolític (ZIF-8). Amb la línia de llum MISTRAL del Sincrotró ALBA, han visualitzat en les cèl·lules aquestes partícules MOFs introduïdes i han pogut comprovar com els gens que transporten s’expressen dins la cèl·lula.
Les MOFs (sigles en anglès de metal-organic frameworks) són uns materials porosos amb una geometria molt ben definida i amb una gran capacitat de càrrega. Per a aplicacions biològiques, la seva alta porositat les converteix en una estratègia eficaç per a la càrrega i la protecció de proteïnes. Tanmateix, el seu ús per a d’altres biomacromolècules, com els àcids nucleics, encara es troba a les beceroles. Ara, un equip d’investigació liderat per la RMIT University de Melbourne ha estat estudiant l’ús de MOFs del tipus ZIF-8 com a possibles vectors de lliurament de gens. Els resultats mostren l’encapsulació de paquets de gens en MOFs ZIF-8 i la seva expressió cel·lular, demostrant que les MOF no danyen l’activitat estructural i funcional de l’àcid nucleic que carreguen, fet essencial per a possibles aplicacions en teràpia gènica pel tractament de malalties.
L’equip científic ha utilitzat un plasmidi (molècula d’ADN que pot expressar proteïnes) que porta gens que codifiquen per la proteïna fluorescent verda (GFP). Aquest plasmidi (plGFP) és molt usat en estudis de biologia molecular i aquí funciona com a macromolècula genètica de prova. El conjunt de plGFP encapsulat dins la MOF ZIF-8 s'ha introduït en cèl·lules epitelials de càncer de pròstata. Per ell mateix, el plGFP no és fluorescent, però quan es transcriu i es tradueix de gen a proteïna GFP, la cèl·lula emet una forta fluorescència verda. Això permet al personal investigador comprovar si el plasmidi d'ADN ha estat transferit i expressat correctament dins de la cèl·lula o no.
La presència intracel·lular de les partícules de plGFP en MOF ZIF-8 s’ha verificat i visualitzat mitjançant dues tècniques correlatives de microscòpia: la crio-epifluorescència i la crio-tomografia de raigs X, disponible a la línia MISTRAL de l’ALBA. Aquest tipus de microscopi, un dels quatre que hi ha al món, és l’única forma de veure cèl·lules totes senceres i en el seu estat natiu, sense fer-ne seccions ni aplicar-los cap tractament. Gràcies a aquesta tècnica, s’ha pogut enregistrar l’expressió gradual de proteïna, traduïda en forma de fluorescència verda en les cèl·lules. Això demostra la capacitat de les MOFs per mantenir la integritat química i física de l’ADN, per tant, la seva funció.
L’alliberament del gen encapsulat dins la cèl·lula i la seva expressió es produeix en períodes de temps relativament prolongats sense que es vegi una citotoxicitat aparent en les cèl·lules. Això té un gran potencial en el camp de la teràpia gènica, on el sistema de lliurament no ha de ser tòxic, i en els casos en què es requereix una expressió genètica sostinguda en el temps en lloc d’un alliberament ràpid de la càrrega terapèutica. S'espera que aquest enfocament porti a trobar un prometedor agent de transport de gens que protegeixi i mantingui l'activitat funcional de l'ADN; i que alhora permeti una expressió personalitzada de gens que condueixi a una persistència de nivells terapèutics in vivo dissenyada específicament.
La teràpia gènica en el tractament de malalties
La teràpia gènica és prometedora en el tractament de malalties; tanmateix, el lliurament dels gens terapèutics representa tot un repte. Avui dia la medicina busca bons vectors de transport de gens. Més del 70% dels assajos clínics de teràpia gènica inclouen vectors virals i només aproximadament el 19% utilitzen sistemes de lliurament no virals. Tot i que la teràpia viral és eficaç i potent per a algunes malalties, els sistemes de lliurament no viral són més segurs i menys immunogènics, relativament barats de produir i amb una gran capacitat de transport d’ADN. Tot i això, encara hi ha reptes importants per resoldre: mantenir la integritat química i física de l’ADN, l’entrada amb èxit a través de la membrana cel·lular, o escapar-se de l’endocitosi dels orgànuls per aconseguir arribar al nucli de la cèl·lula i així aconseguir l’expressió del gen. Per tant, el desenvolupament de millors sistemes sintètics que permetin als vectors superar aquestes limitacions és essencial i aquest estudi remarca el potencial de les MOFs per fer-ho i esdevenir sistemes de teràpia gènica adequats per al lliurament d'ADN.
Amb la col·laboració de la Fundació Espanyola per a la Ciència i la Tecnologia. El Sincrotró ALBA forma part de la xarxa d'Unitats de Cultura Científica i de la Innovació (UCC+i) de la Fundació Espanyola per a la Ciència i la Tecnologia (FECYT) i ha rebut suport a través del projecte FCT-20-15798.