Sincrotrón ALBA
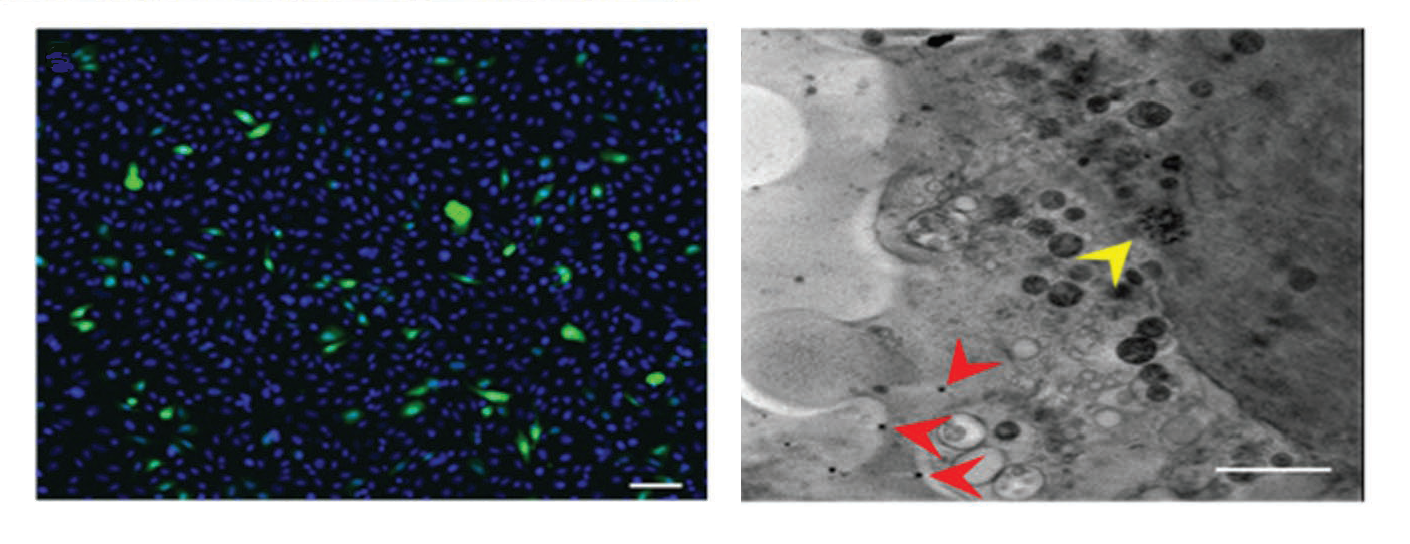
Un equipo de investigación formado por la Universidad RMIT, CSIRO Manufacturing, la Universidad de Nueva Gales del Sur, la Universidad de Tecnología de Graz y la Universidad de Adelaide, en Australia, han demostrado que las MOFs pueden ser un método fácil y eficiente para transportar paquetes de genes intactos y de gran tamaño para aplicarse en terapia génica. El estudio consta de la encapsulación de un paquete de genes en MOFs del tipo framework-8 de imidazolato zeolítico (ZIF-8). Con la línea de luz MISTRAL del Sincrotrón ALBA, han visualizado en las células estas partículas MOFs introducidas y han podido comprobar como los genes que transportan se expresan dentro la célula.
Las MOFs (siglas en inglés de metal-organic frameworks) son unos materiales porosos con una geometría muy bien definida y con una gran capacidad de carga. Para aplicaciones biológicas, su alta porosidad las convierte en una estrategia eficaz para la carga y protección de proteínas. Sin embargo, su uso para otras biomacromoléculas, como los ácidos nucleicos, todavía está en sus inicios. Ahora, un equipo de investigación liderado por la RMIT University de Melbourne ha estado estudiando el uso de MOFs del tipo ZIF-8 como posibles vectores de transporte de genes. Los resultados muestran la encapsulación de paquetes de genes en MOFs ZIF-8 y su expresión celular, demostrando que las MOF no dañan la actividad estructural y funcional del ácido nucleico que cargan, hecho esencial para posibles aplicaciones en terapia génica para el tratamiento de enfermedades.
El equipo científico ha usado un plásmido (molécula de ADN que puede expresar proteínas) que lleva genes que codifican para la proteína fluorescente verde (GFP). Este plásmido (plGFP) es muy usado en estudios de biología molecular y aquí funciona como macromolécula genética de prueba. El conjunto de plGFP encapsulado dentro la MOF ZIF-8 se ha introducido en células epiteliales de cáncer de próstata. Por sí mismo, el plGFP no es fluorescente, pero cuando se transcribe y se traduce de gen a proteína GFP, la célula emite una fuerte fluorescencia verde. Esto permite al personal investigador comprobar si el plásmido de ADN ha sido transferido y expresado correctamente dentro la célula o no.
La presencia intracelular de las partículas de plGFP en MOF ZIF-8 se ha verificado y visualizado mediante dos técnicas correlativas de microscopia: la crio-epifluorescencia y la crio-tomografía de rayos X, disponible a la línea MISTRAL del ALBA. Este tipo de microscopio, uno de los cuatro que hay en el mundo, es la única forma de ver células todas enteras y en su estado nativo, sin hacer secciones ni aplicar ningún tratamiento. Gracias a esta técnica, se ha podido registrar la expresión gradual de proteína, traducida en forma de fluorescencia verde en las células. Esto demuestra la capacidad de las MOFs para mantener la integridad química y física del ADN, por tanto, su función.
La liberación del gen encapsulado dentro la célula y su expresión se produce en períodos de tiempo relativamente prolongados sin que se vea una citotoxicidad aparente en las células. Esto tiene un gran potencial en el campo de la terapia génica, donde el sistema de transferencia no tiene que ser tóxico, y en los casos en que se requiere una expresión genética sostenida en el tiempo en lugar de una liberación rápida de la carga terapéutica. Se espera que este enfoque lleve a encontrar un prometedor agente de transporte de genes que proteja y mantenga la actividad funcional del ADN; y que a la vez permita una expresión personalizada de genes que conduzca a una persistencia de niveles terapéuticos in vivo diseñada específicamente.
La terapia génica en el tratamiento de enfermedades
La terapia génica es prometedora en el tratamiento de enfermedades; asimismo, el transporte de los genes terapéuticos representa un gran reto. Actualmente la medicina busca buenos vectores de transporte de genes. Más del 70% de los ensayos clínicos de terapia génica incluyen vectores virales y solamente el 19% aproximadamente usan sistemas no virales. Aunque la terapia viral es eficaz y potente para algunas enfermedades, los sistemas de transporte no viral son más seguros y menos inmunogénicos, relativamente baratos de producir y con una gran capacidad de transporte de ADN. Aun así, todavía hay retos importantes por resolver: mantener la integridad química y física del ADN, la entrada con éxito a través de la membrana celular, o escaparse de la endocitosis de los orgánulos para alcanzar el núcleo de la célula y así conseguir la expresión del gen. Por tanto, el desarrollo de mejores sistemas sintéticos que permitan a los vectores superar estas limitaciones es esencial y este estudio remarca el potencial de las MOFs para hacerlo y llegar a ser sistemas de terapia génica adecuados para el transporte de ADN.
Con el apoyo de la Fundación Española para la Ciencia y la Tecnología. El Sincrotrón ALBA forma parte de la red de Unidades de Cultura Científica y de la Innovación (UCC+i) de la Fundación Española para la Ciencia y la Tecnología (FECYT) y ha recibido apoyo a través del proyecto FCT-20-15798.