Sincrotró ALBA
L'estructura tridimensional d'aquest enzim ha estat obtinguda gràcies a la llum del Sincrotró ALBA i ha permès a l'equip de la Universitat Autònoma de Barcelona identificar un nou mecanisme de regulació d’un enzim que controla la vida mitjana de les proteïnes cel·lulars. L’estudi ha estat publicat a la revista Nature Communications.
Cerdanyola del Vallès, 31 de gener del 2019.
El control del temps de vida de les proteïnes cel·lulars és un mecanisme essencial per regular la seva activitat i perquè funcioni correctament el cicle cel·lular. Aquest cicle permet que les cèl·lules puguin dividir-se i així fer que els teixits creixin i es regenerin. El control de les diferents etapes del cicle cel·lular està exercit per diferents tipus de proteïnes que es van substituint a mesura que avança el cicle. Les cèl·lules han dissenyat un mecanisme per marcar les proteïnes que han de substituir-se per ser destruïdes. Aquest procés s'anomena ubiquitinació, i la marca consisteix en la formació d'una cadena amb la proteïna ubiquitina. Les proteïnes marcades (amb ubiquitina) són eliminades per una mena de gran deixalleria cel·lular anomenada proteosoma que s'encarrega de triturar-les. La regulació d'aquest procés és molt important perquè el cicle cel·lular funcioni correctament, altrament pot comportar alteracions en la proliferació cel·lular que podrien conduir a processos cancerígens, on els teixits creixen sense cap control.
En el treball
que l'equip del IBB (Institut de Biotecnologia i Biomedicina) de la UAB acaba de publicar a la revista
Nature Communications es presenta la caracterització estructural i el descobriment d'un nou mecanisme de regulació d'un enzim que talla les cadenes d'ubiquitina, que s'anomena USP25. Aquest enzim elimina les cadenes d'ubiquitina de les proteïnes marcades i té un impacte important en la seva funció cel·lular en evitar que siguin degradades pel proteosoma.
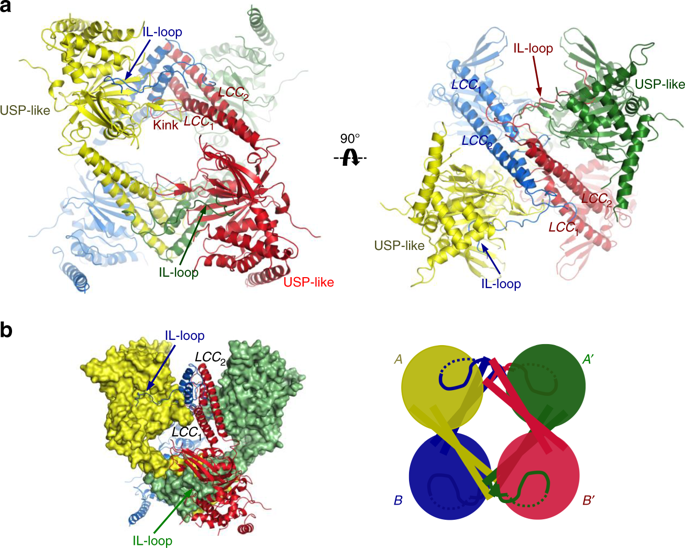
L'estructura tridimensional d'aquest enzim, obtinguda gràcies a la cristal·lografia de proteïnes i a la llum del Sincrotró ALBA a la línia

USP25 és un homotetràmer format per l'assemblatge de dos dímers. a Representació del tetràmer de USP25. Cada subunitat està representada per un color diferent. Els dominis LLC i IL-loop estan marcats. Diferents orientacions del tetràmer de USP25. b Representació mixta de la superfície i la cinta de l'estructura de l'homotetràmer de USP25. Dibuix del conjunt del tetràmer format pels dos homodímers (A, A′ i B, B′).
Imatge de Nature Communications.
Liu, B., Surena-Gómez, M., Zhen, Y., Amador, V., Reverter, D. A quaternary tetramer assembly inhibits the deubiquitinating activity of USP25. Nature Communications (2018 ). DOI: 10.1038 / s41467-018-07510-5.