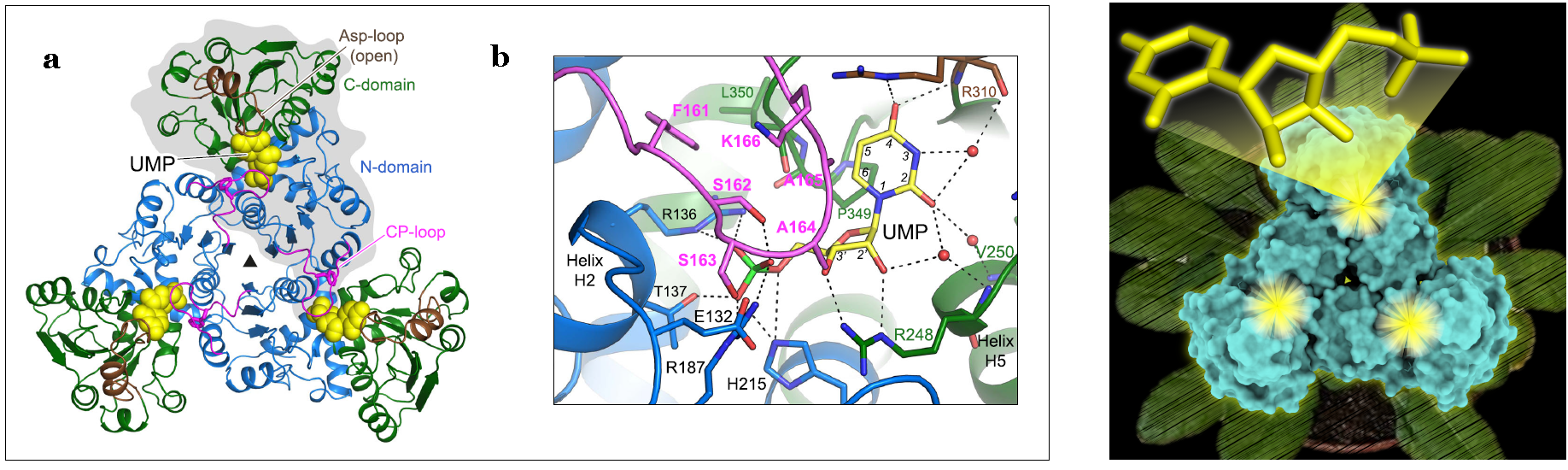
Izquierda: estructura de la ATC de Arabidopsis unida a UMP. a) Estructura cristalina del trímero atATC con cada subunidad ligada a una molécula de UMP (esferas amarillas). Se muestra una subunidad sobre fondo gris. b) Detalle del centro activo con UMP unido. Las moléculas de agua se muestran como esferas rojas. Las interacciones electrostáticas se indican con líneas discontinuas. Derecha: estructura de la ATC de Arabidopsis en representación superficial (en cian) con los tres centros activos indicados en amarillo. En la parte superior, se muestra el modelo atómico de UMP, el inhibidor natural de la proteína. El fondo muestra una planta de Arabidopsis.
Cerdanyola del Vallès, 7 julio 2021 Un nuevo estudio sobre las pirimidinas y sobre cómo estas son sintetizadas en la natura ha sido publicado recientemente en Nature Communications. Las pirimidinas son moléculas orgánicas esenciales para nuestro material genético, ya que son unas de las moléculas que forman el ADN. Juegan también otros papeles clave en muchos otros procesos celulares.
En particular, el equipo de investigación ha estudiado la proteína llamada aspartato transcarbamilasa o ATC, una enzima con un rol central en la síntesis de pirimidinas en todos los seres vivos. Previamente, ya habían caracterizado la estructura y función de la ATC humana. Sin embargo, muy poco se conoce sobre la ATC de las plantas, solamente que tiene un mecanismo de regulación único: es inhibida por la molécula uridina 5-monofosfato (UMP), producto de la ruta metabólica a partir de la cual se fabrican todos los otros nucleótidos de pirimidina.
Con técnicas de luz de sincrotrón, el equipo ha determinado por primera vez la estructura de una ATC de una planta, concretamente de la planta modelo Arabidopsis thaliana, sola y unida a UMP (su inhibidor natural); y también formando un complejo con PALA, un inhibidor diseñado que imita el estado de transición de la reacción enzimática. Los datos estructurales obtenidos en ambos sincrotrones, ALBA i ESRF, combinados con otros análisis, han permitido describir las bases del mecanismo funcional de la enzima y cómo su actividad es regulada en las plantas.
El equipo científico ha hecho dos descubrimientos innovadores: en primer lugar, que inesperadamente UMP inhibe la enzima mediante la unión directa y el bloqueo de su centro activo. En segundo lugar, que a pesar de ser un trímero con tres centros activos, la enzima cataliza la reacción solamente en un centro activo cada vez.
Desde la estructura proteica al diseño de nuevo inhibidores y hasta el diagnóstico de una epilépsia rara
Este es un proyecto de investigación básica, enfocado en entender la ATC, una enzima ubicua indispensable para el crecimiento y proliferación celular. ATC y otras enzimas involucradas en la síntesis de pirimidinas han estado durante mucho tiempo dianas atractivas para el diseño de compuestos antiproliferativos para combatir el cáncer y otras enfermedades. La farmacéutica Bayer ha financiado parte del proyecto a través del programa Grants4Targets, por el interés en fabricar inhibidores de la ATC como potenciales herbicidas. Paralelamente, el grupo de Santiago Ramón-Maiques estudia la ATC en humanos, donde la enzima forma parte de un complejo proteico mucho más grande llamado CAD, una diana antitumoral que ha tenido su laboratorio ocupado durante los diez últimos años. "Para inhibir selectivamente el complejo CAD, primero hemos de entender cómo funciona", explica Santiago. Preguntado sobre por qué estudiar las plantas cuando el objetivo es manipular una proteína humana, explica que “es difícil fabricar compuestos antitumorales contra la actividad ATC de CAD. ¿Por qué no mirar primero las soluciones ya encontradas por la naturaleza a través de millones de años de evolución?” Y esto es lo que precisamente han descubierto: las soluciones únicas encontradas por las plantas para inhibir selectivamente la ATC. “Hemos aprendido una lección importante de nuestros parientes vegetales. Ahora la cuestión es cómo se traduce el modo de unión de UMP a la ATC de las plantas para diseñar nuevos inhibidores antiproliferativos específicos contra la ATC humana” comenta Santiago en hablar sobre los próximos pasos de la investigación.
El grupo forma parte del CIBER de Enfermedades Raras (CIBERER) y participa activamente en la correcta diagnosis de una enfermedad neurometabólica rara causada por defectos en CAD. La enfermedad fue descrita por primera vez el 2015, en una criatura de 4 años que presentaba mutaciones en la ATC. "No sabíamos por qué la mutación era patogénica porque no sabíamos cómo funciona la ATC. Cuanto más aprendemos sobre la proteína, mejor podemos diagnosticar los niños afectados por esta enfermedad”, explica Santiago. En este sentido, la nueva información obtenida sobre la ATC vegetal ayuda a comprender mejor los mecanismos de funcionamiento de la enzima en personas y a predecir el potencial patológico de las variantes clínicas.
El proyecto es una colaboración de los grupos de Torsten Möhlmann (Universität Kaiserslautern) y de Santiago Ramón-Maiques (Instituto de Biomedicina de Valencia IBV-CSIC y CIBERER). Todo el trabajo estructural ha sido realizado por el grupo de Ramón-Maiques. El equipo contó también con la experiencia de Adrián Velázquez-Campoy (Universidad de Zaragoza y ISS Aragón) para hacer los experimentos ITC. Las estructuras obtenidas en la línea de luz XALOC de ALBA han resultado clave para demostrar los mecanismos de inhibición de los centros activos de la ATC de las plantas.
Referencia: Leo Bellin, Francisco Del Caño-Ochoa, Adrián Velázquez-Campoy, Torsten Möhlmann & Santiago Ramón-Maiques. Mechanisms of feedback inhibition and sequential firing of active sites in plant aspartate transcarbamoylase. Nat Commun 12, 947 (2021). https://doi.org/10.1038/s41467-021-21165-9
Con la colaboración de la Fundación Española para la Ciencia y la Tecnología. El Sincrotrón ALBA forma parte de la red de Unidades de Cultura Científica y de la Innovación (UCC+i) de la Fundación Española para la Ciencia y la Tecnología (FECYT) y ha recibido apoyo a través del proyecto FCT-20-15798.





