Los dominios SH3 se encuentran en numerosas proteínas, en diversa cantidad y combinaciones. Estos dominios SH3 están relacionados con la desregulación de las vías de señalización durante el desarrollo del cáncer y también se asocian con otras patologías como el SIDA, la osteoporosis y otros procesos inflamatorios. Resolver estas estructuras a nivel atómico permite un análisis detallado de su función y características.
La línea de luz BL13-XALOC, dedicada a la cristalografía macromolecular, ha ayudado a los profesores Bacarizo y Cámara-Artigas a medir los cristales de estas estructuras a resolución atómica (0.98 Å). Para recopilar los datos mediante difracción de rayos X se utilizó el detector PILATUS.
Estas estructuras han sido depositadas en el Banco de Datos de Proteínas (PDB, en sus siglas en inglés) y la investigación ha sido publicada en Acta Crystallographica Section D (Atomic resolution structures of the c-Src SH3 domain in complex with two high-affinity peptides from classes I and II. Julio Bacarizo and Ana Camara-Artigas, Acta Cryst. (2013). D69, 756–766; doi:10.1107/S0907444913001522).
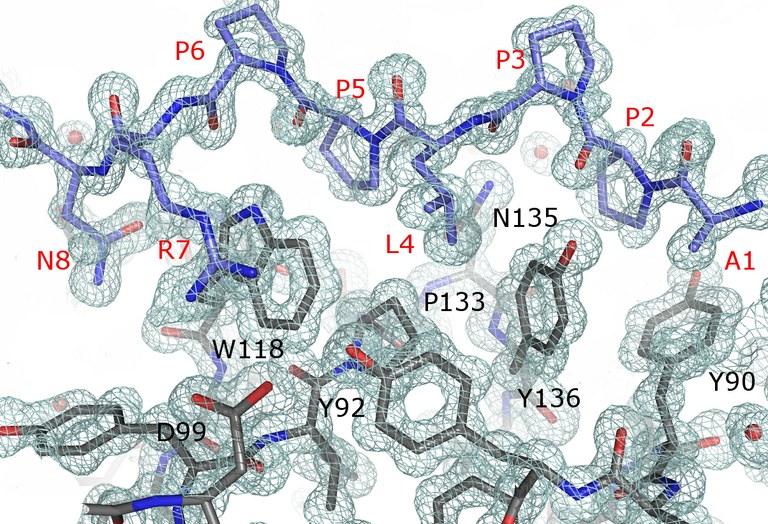
Figura 1. La imagen muestra el mapa de densidad electrónica 2Fo-Fc a 1.5 σ para el péptido APP12 (en azul, etiqueta en rojo) y los residuos del centro de unión de la proteína Thr98Asp mutante del dominio c-Src-SH3 (en gris, etiqueta en negro).




