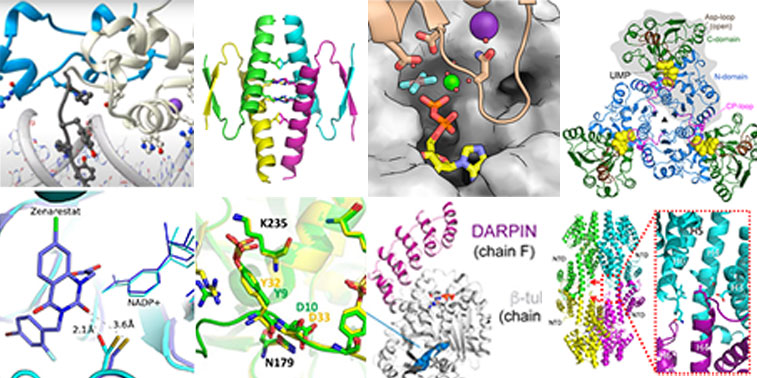
Collage de diferentes estructuras de proteínas resueltas en la línea de luz XALOC.
El Sincrotrón ALBA ha alcanzado un hito importante. Después de una década dando servicio a su comunidad de usuarios, la línea de luz de cristalografía macromolecular (MX) XALOC ha determinado 1.000 estructuras de proteínas y las publicado en el Protein Data Bank (PDB). Las macromoléculas y complejos macromoleculares dilucidados están implicados en una gran variedad de procesos biológicos y áreas de investigación relevantes, como el desarrollo de fármacos y el conocimiento de las enfermedades o las funciones de los organismos vivos.
Las estructuras han sido reveladas gracias a los potentes rayos X generados en el Sincrotrón ALBA y a la configuración experimental de la línea de luz XALOC, que ofrece una variedad de métodos cristalográficos, desde los clásicos como la crio-cristalografía y difracción anómala hasta los modernos sistemas de cristalografía en serie resuelta a temperatura ambiente.
En concreto, la estructura de proteína número 1.000 depositada en el PDB ha sido resuelta por un equipo del Instituto de Química Física Blas Cabrera del CSIC y otras instituciones de investigación del Reino Unido. IP3K, como se denomina la estructura, es una enzima que se une a la proteína IP3, un segundo mensajero fundamental en las células, crucial en procesos como la memoria, el sistema inmunológico o la progresión tumoral. Los resultados de esta investigación, publicada recientemente en Nature Communications, pueden ser de gran ayuda en el diseño de ligandos selectivos contra las proteínas de unión a IP3, posibilitando nuevas terapias en diferentes campos biológicos, incluida la investigación del cáncer.
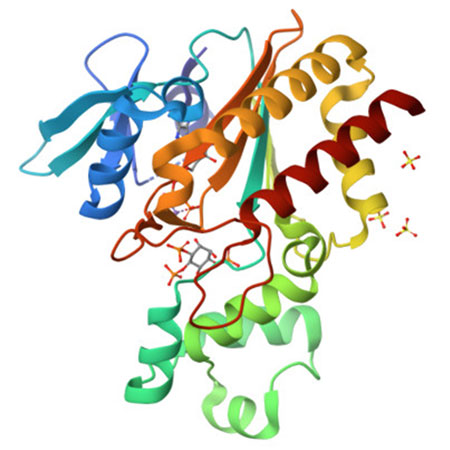
Figura. Imagen de la estructura 3D de IP3K, Inositol-trifosfato 3-quinasa A, proteína número 1.000 resuelta en la línea de luz XALOC, Sincrotrón ALBA..
"Obtener 1.000 estructuras en 11 años con una sola línea de luz es un logro notable, ya que demuestra el gran rendimiento del instrumento y la implicación de nuestros usuarios a lo largo de estos años", afirma Roeland Boer, científico responsable de la línea de luz XALOC. "Estamos muy orgullosos de este resultado que nos empuja a mantener y fortalecer nuestro compromiso de seguir sirviendo a la comunidad ahora con una segunda línea de luz dedicada a la cristalografía macromolecular, XAIRA, que recibirá a los primeros usuarios en otoño de 2024", dice Judith Juanhuix, jefa de la sección de Ciencias de la Vida del Sincrotrón ALBA.
Luz para innumerables desafíos científicos
Las proteínas son moléculas grandes y complejas que desempeñan un papel clave en los organismos vivos, participando en la mayoría de las funciones de las células. Determinar su estructura es vital para saber más sobre las ciencias biológicas con el fin de desarrollar nuevos fármacos y terapias.
Algunas de las proteínas resueltas en el Sincrotrón ALBA han sido identificadas como biomarcadores de enfermedades como el cáncer, la diabetes y la obesidad. En otros casos sirvieron para ver cómo los fármacos se unen a proteínas asociadas a infecciones como el SARS-CoV2, el VIH-1 o la enfermedad del sueño, entre otras. Y también ayudaron a explicar la ineficacia de algunos fármacos descatalogados.
La resistencia a los antibióticos se ha comprendido mejor estudiando la alta tasa de división de las bacterias o cómo las bacterias comparten material genético en la línea de luz XALOC. Su campo de aplicación excede el sector biomédico, ya que también ha mostrado cómo las plantas crecen y pueden diseñarse para resistir enfermedades o condiciones climáticas severas como inundaciones o sequías.
XALOC ha acogido varios experimentos industriales destinados a resolver la estructura de las proteínas, como la colaboración con Helix Biostructures or Esteve para estudiar inhibidores contra el dolor.
Mapeando lo más pequeño
La cristalografía de rayos X en bio-macromoléculas se ha utilizado ampliamente en sincrotrones en los últimos 30 años y todavía está evolucionando para ofrecer soluciones en el desarrollo de fármacos y la dinámica de procesos enzimáticos de organismos vivos. La técnica usa los patrones de difracción producidos por cristales de macromoléculas para determinar su estructura con una resolución casi atómica.
La gran brillantez y la posibilidad de seleccionar los rayos X que permite el sincrotrón ha hecho que sea una herramienta extremadamente eficiente para la biología estructural. El 90% de todas las proteínas depositadas en el Protein data Bank se han obtenido en sincrotrones.
La evolución de esta técnica en los últimos años ha permitido recoger datos de forma remota y automática, realizando experimentos resueltos en el tiempo y resolviendo estructuras con cristales cada vez más pequeños.


Imágenes de la línea de luz XALOC en el Sincrotrón ALBA. A la izquierda, el investigador Fernando Gil de ALBA.




