Sincrotrón ALBA
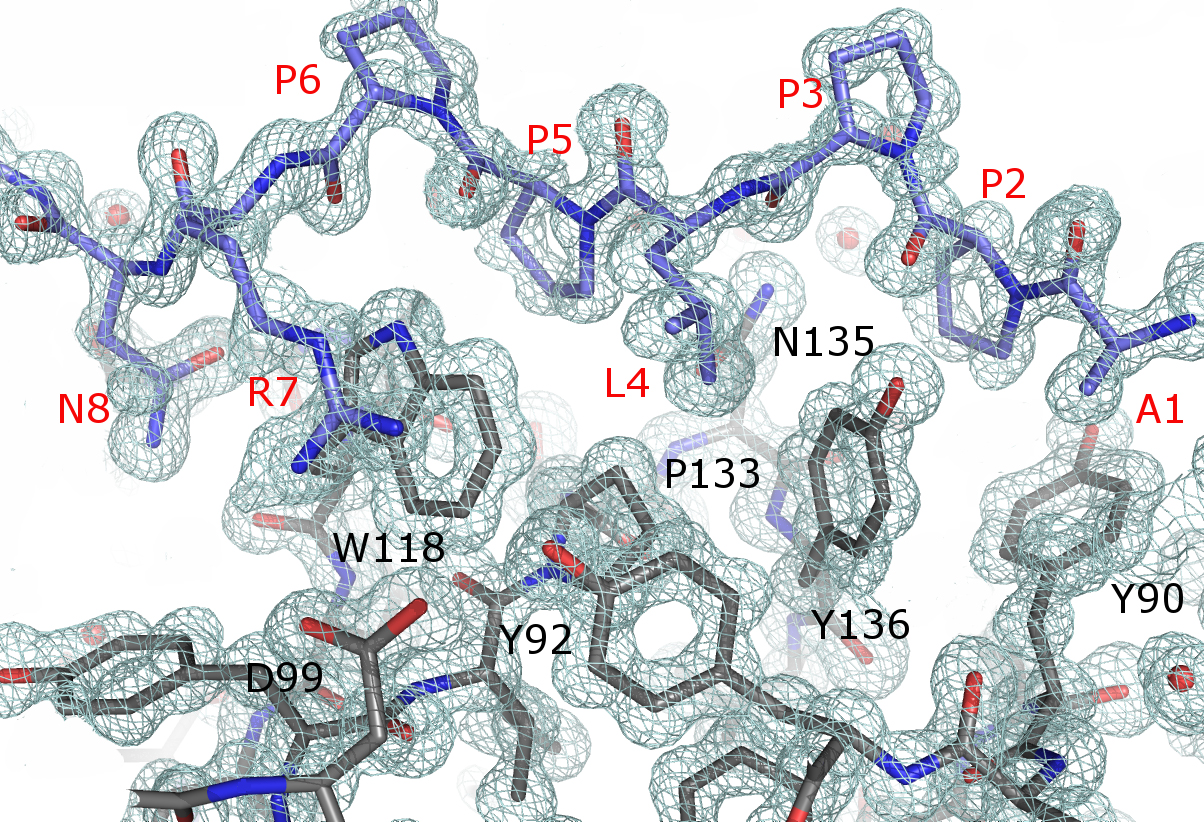
Los profesores Julio Bacarizo y Ana Cámara-Artigas, de la Universidad de Almería, han resuelto a nivel atómico estructuras de la proteína Thr98Asp del dominio SH3 de la quinasa c-Src unido al péptido de alta afinidad APP12. Se trata de la primera resolución atómica realizada en el Sincrotrón ALBA. La información obtenida en la línea de luz XALOC podría tener implicaciones en enfermedades como el cáncer, el SIDA o la osteoporosis.
Los dominios SH3 se encuentran en numerosas proteínas, en diversa cantidad y combinaciones. Estos dominios SH3 están relacionados con la desregulación de las vías de señalización durante el desarrollo del cáncer y también se asocian con otras patologías como el SIDA, la osteoporosis y otros procesos inflamatorios. Resolver estas estructuras a nivel atómico permite un análisis detallado de su función y características.
La línea de luz BL13-XALOC, dedicada a la cristalografía macromolecular, ha ayudado a los profesores Bacarizo y Cámara-Artigas a medir los cristales de estas estructuras a resolución atómica (0.98 Å). Para recopilar los datos mediante difracción de rayos X se utilizó el detector PILATUS.
Estas estructuras han sido depositadas en el Banco de Datos de Proteínas (PDB, en sus siglas en inglés) y la investigación ha sido publicada en Acta Crystallographica Section D (
Atomic resolution structures of the c-Src SH3 domain in complex with two high-affinity peptides from classes I and II
. Julio Bacarizo and Ana Camara-Artigas,
Acta Cryst. (2013). D69, 756–766
; doi:10.1107/S0907444913001522).

Figura 1. La imagen muestra el mapa de densidad electrónica 2Fo-Fc a 1.5 σ para el péptido APP12 (en azul, etiqueta en rojo) y los residuos del centro de unión de la proteína Thr98Asp mutante del dominio c-Src-SH3 (en gris, etiqueta en negro).