Sincrotrón ALBA
Un equipo de investigación internacional ha obtenido por primera vez la estructura de la proteína sensible a la luz y bomba de sodio KR2 en su estado activo. El descubrimiento aporta una descripción del mecanismo tras la transferencia impulsada por luz del ion sodio a través de la membrana celular. Entender cómo funciona la KR2 es crucial para optimizar las características funcionales de esta proteína y poder utilizarla como base para nuevas herramientas optogenéticas.
Un equipo de investigación internacional formado por investigadores del Moscow Institute of Physics and Technology (MIPT, Rusia); La Universidad de Grenoble y el European Synchrotron Radiation Facility (Francia); el Jülich Research Center, la Aachen University, el Max Planck Institute of Biophysics, y el European Molecular Biology Laboratory (Alemania); así como el Sincrotrón ALBA, ha obtenido por primera vez la estructura de la proteína sensible a la luz y bomba de sodio KR2 en su estado activo. El descubrimiento aporta una descripción del mecanismo tras la transferencia impulsada por luz del ion sodio a través de la membrana celular. El artículo se publicó en Nature Communications.
La KR2 es miembro de una gran familia de rodopsinas microbianas – proteínas sensibles a la luz presentes en la membrana celular de las arqueas, bacterias, virus y eucariotas. Estas proteínas tienen un amplio rango de funciones, incluyendo el transporte de iones impulsado por luz a través de la membrana. Estos canales y bombas de iones son las herramientas principales de la optogenética, un campo en auge de la biomedicina centrado en controlar las células del cuerpo iluminándolas con luz.
La optogenética ganó relevancia debido a sus contribuciones a técnicas mínimamente invasivas para la investigación del cerebro y tratamientos de trastornos degenerativos dirigidos a Alzheimer, Parkinson y otras enfermedades. Más allá de eso, la optogenética permite revertir la pérdida de visión y oído y restaurar la actividad muscular.
A pesar de sus muchos éxitos, mejorar el desarrollo de la optogenética se complica debido al número limitado de proteínas disponibles que sean adecuadas para la activación e inhibición celular. Por ejemplo, la herramienta optogenética más utilizada, la canalrodopsina 2, cuya estructura se reportó originalmente en la revista Science por parte de investigadores y graduados del MIPT, puede transportar iones de sodio, potasio y calcio, así como protones. La baja selectividad de la proteína lleva a efectos secundarios indeseados en las células. Como resultado, optimizar los protocolos para utilizar herramientas optogenéticas es actualmente costoso y requiere de mucho tiempo.
La búsqueda de proteínas nuevas y más selectivas es una prioridad para la optogenética. Una de las candidatas, la rodopsina KR2 descubierta en 2013, es una herramienta única que únicamente transporta de forma selectiva iones de sodio a través de la membrana bajo condiciones fisiológicas. Entender cómo funciona la KR2 es crucial para optimizar las características funcionales de la proteína y utilizarla como base para nuevas herramientas optogenéticas.
Biofísicos del MIPT publicaron las primeras estructuras de la KR2 en sus varias formas en 2015 y 2019. Entre otras cosas, mostraron que la proteína se organiza en pentámeros en la membrana, y que dicho comportamiento es vital para su funcionamiento.
A pesar de esto, todos los modelos descritos hasta la fecha han observado la proteína en su estado inactivo o fundamental. Sin embargo, es solo en su estado activo- tras ser iluminada- cuando la proteína transporta realmente el sodio. Para entender como funciona la bomba KR2, los investigadores han obtenido y descrito ahora su estructura en alta resolución en su estado activo.
“Empezamos utilizando la aproximación tradicional, activando la KR2 en cristales de proteína precrecidos iluminándolos con un láser y tomando una instantánea del estado activo congelando rápidamente los cristales a 100 Kelvin,” cuenta el primer autor del estudio, el estudiante doctoral del MIPT Kirill Kovalev. “Tuvimos suerte, porque ese tipo de manipulaciones pueden destruir los cristales. Para evitarlo, tuvimos que calibrar de forma precisa la longitud de onda y la potencia del láser y encontrar el tiempo de exposición óptimo.”
Producir el gran número de cristales de rodopsina KR2 de alta calidad necesario para los experimentos ha sido posible gracias al equipamiento exclusivo del Centro de Investigación para Mecanismos Moleculares de Envejecimiento y Enfermedades Asociadas a la Edad del MIPT.
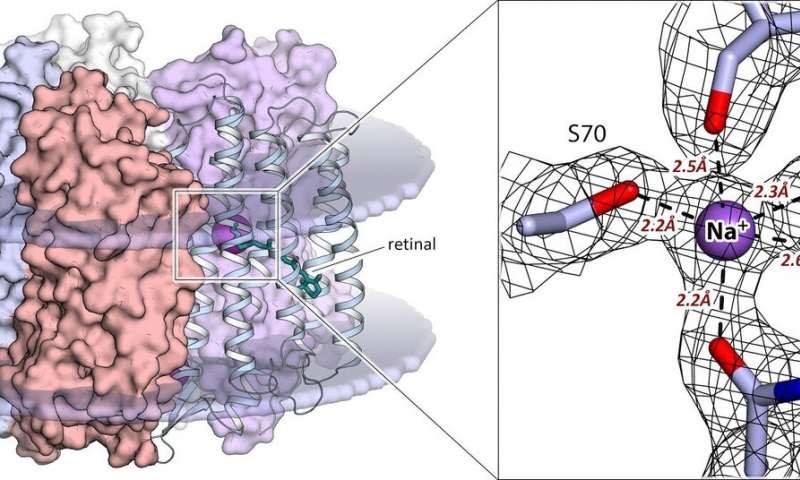
El hallazgo más significativo del estudio es identificar los residuos de amino ácido de la proteína que se unen al ion de sodio en el interior de la molécula KR2. Son el factor que determina la selectividad de la rodopsina hacia un tipo de iones en particular. Además, una estructura de alta resolución para el estado activo de la proteína a 2,1 angstroms- 21 centésimas mil-millonésimas- ha revelado la configuración precisa del sitio de unión del ion de sodio en el centro activo de la proteína. Por primera vez, el equipo mostró que el sitio de unión de la KR2 se ha optimizado para los iones de sodio en el curso de la evolución de la rodopsina. Esto significa que la estructura obtenida en el estudio para el estado activo es más adecuada para el diseño racional de la siguiente generación de herramientas optogenéticas basadas en KR2.
“Durante nuestro trabajo, también obtuvimos la estructura del estado activo de la KR2 a temperatura ambiente,” añade Kovalev. “Para conseguirlo, tuvimos que actualizar los ya bien conocidos protocolos para recopilar datos cristalográficos. Además, utilizamos fuentes de radiación de sincrotrón para sacar partido a las técnicas cristalográficas en serie, que están creciendo en popularidad ahora mismo.”
En concreto, se obtuvieron datos de cristalografía de milisegundos en serie del estado O de la KR2 a temperatura ambiente en la línea de luz XALOC del Sincrotrón ALBA.
La estructura de la KR2 a temperatura ambiente confirmó que el modelo de proteína producido a partir de la instantánea a baja temperatura es correcto. Esto aportó una demostración directa de que la congelación criogénica no afectó a la estructura interna de la rodopsina.
Las estructuras reportadas en el artículo han permitido a los científicos aportar por primera vez una descripción del transporte activo impulsado por luz del ion sodio a través de la membrana celular. En concreto, el estudio muestra que el transporte de sodio implica muy probablemente un mecanismo hibrido compuesto por transporte de protones en relevo y difusión pasiva de iones a través de las cavidades polares en la proteína. El mecanismo propuesto por los investigadores se ha confirmado a través de estudios funcionales de formas mutadas de KR2 y simulaciones de dinámica molecular de la liberación del ion sodio de la proteína.
“El transporte de iones a través de la membrana celular es un proceso biológico fundamental. Dicho esto, el transporte del ion sodio debería ser posible gracias a un mecanismo distinto al involucrado en el de transporte de protones,” explica Valentin Gordeliy, el director de investigación en el instituto de Grenoble para Biología Estructural y coordinador científico del Centro de Investigación para Mecanismos Moleculares de Envejecimiento y Enfermedades Asociadas a la Edad del MIPT. “Por primera vez, hemos visto como un ion de sodio se enlaza en el interior de la molécula de rodopsina y hemos comprendido el mecanismo para la liberación de iones al interior del espacio intracelular.”
Los biofísicos están convencidos de que sus descubrimientos no solo revelan los principios fundamentales en los que se basa el transporte iónico a través de la membrana, sino que además será de utilidad para la optogenética. El MIPT continua con el desarrollo de formas optimizadas de la proteína KR2 para expandir las herramientas para la investigación del cerebro y las terapias contra enfermedades neurodegenerativas.
Enlace a la noticia original: https://phys.org/news/2020-05-biophysicists-reveal-optogenetic-tool.html
Con el apoyo de la Fundación Española para la Ciencia y la Tecnología. El Sincrotrón ALBA forma parte de la red de Unidades de Cultura Científica y de la Innovación (UCC+i) de la Fundación Española para la Ciencia y la Tecnología (FECYT) y ha recibido apoyo a través del proyecto FCT-20-15798.